研究概要
研究のコンセプト
生命現象の解明と生体内で駆動する新材料の創出には化学の力が不可欠です。我々は有機化学・物理化学・生化学の最新の知見を活かし、未知の生命現象を解き明かす新しい分析手法の開発を目指しています。さらに、紫外線や放射線が作り出す物質の励起状態を操って、生体内部で駆動するオリジナルな機能性材料を創造したいと考えています。
1.生体組織内の低酸素環境を映す分子プローブ
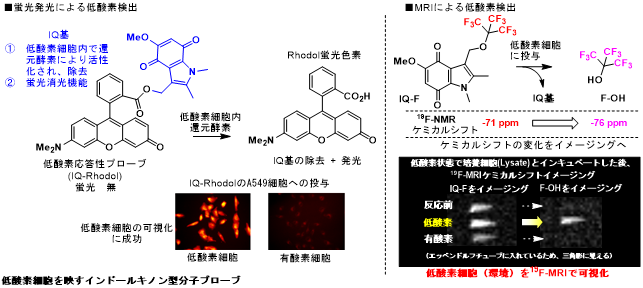
酸素濃度の低い細胞は、虚血性疾患や固形がん等の重大な疾病に発生することから、迅速な検出手法の開発が切望されてきました。我々は、低酸素細胞内でシグナルを発信する分子プローブを設計し、低酸素細胞の可視化を試みています。まず、インドールキノン誘導体(IQ)の細胞内における特性に着目して、低酸素プローブを設計しました。
IQは、
1.低酸素細胞内の還元酵素によって還元・除去される
2.蛍光色素の消光作用を示す
という機能を持ちます。そこで、IQを蛍光性分子に導入した低酸素応答性蛍光プローブ群を合成し、細胞に投与した結果、プローブは肺がん細胞A549の低酸素細胞内で選択的に活性化され、IQを脱離して強い蛍光を示すことを明らかにし、低酸素細胞を蛍光により可視化できることを示しました(左図)。
この分子設計はMRIによる低酸素環境の可視化へと応用できます。次に、ケミカルシフトの異なるNMRシグナルを個々に可視化する手法であるケミカルシフトイメージングを活用して、低酸素細胞をMRIで可視化することを試みました。具体的には、IQを19Fでラベルしたプローブ群IQ-Fを設計しました。IQ-Fは低酸素細胞内で還元され、対応するアルコールF-OHを遊離します。IQ-FとF-OHは異なるケミカルシフトを示すため、それぞれをMRIで観測すれば、低酸素細胞が可視化できます。実際にIQ-Fを合成して細胞に投与したところ、想定通りの機能を示し、19F-MRIで低酸素細胞を選択的に可視化できることを明らかにしました(右図)。
2.腫瘍組織内の酸素濃度変動を可視化する発光性分子プローブ(京都大学との共同研究)
腫瘍内の酸素濃度は必ずしも低い状態で一定ではなく、短い時間間隔で変動していることが示されています。酸素濃度は腫瘍の悪性度の指標である上に、適切な治療を提供するうえで不可欠であることから、腫瘍組織の酸素濃度をリアルタイムに追跡可能な手法の開発が求められています。我々は、ルテニウム(Ru)錯体のりん光に着目し、酸素濃度変動の計測プローブの開発を試みています。ルテニウム錯体のりん光は酸素へのエネルギー移動(ET)により消光され、低酸素条件下で強く発光します。また、ETは瞬時に進行し、かつ発光・消光は酸素の増減に対応して可逆的に起こることが知られています。我々は、プローブの腫瘍集積性を高める目的で低酸素標的置換基ニトロイミダゾールを導入した錯体Ru-NIを合成しました。プローブを担癌マウスに投与した結果、Ru-NIはマウスのがん組織に特異的に集積し、発光しました。また、腫瘍内の発光強度を追跡することにより、秒単位の速さで腫瘍組織内の酸素濃度が刻々と変動することを明らかにしました。

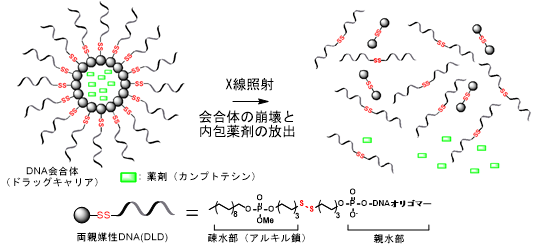
3.放射線活性化型ドラッグキャリアの開発
近年新しいがんの治療法として、抗がん剤と放射線療法を併用する化学放射線療法が着目されています。この手法は、手術に匹敵する治療成績が報告されていることから、がん治療におけるダメージの少ない新手法として期待されています。しかしながら、現時点では、使用する抗がん剤の副作用等の理由から、患者の容態によっては適用できないといった問題点も指摘されています。 こうした問題の解決を目的として、我々は化学放射線療法に適応可能で、かつ副作用の軽い放射線活性化型のドラッグキャリアの開発を進めてきました。このキャリアは、各種抗がん剤を内包する一方、放射線の照射によってキャリアが崩壊し、内包薬剤が放出される分子システムです。すなわち、薬剤を内包したキャリアを投与しただけでは何ら薬効を示さないが、患部に放射線照射を行うと、薬剤活性を示します。従って、このドラッグデリバリーシステムを活用することによって、副作用が低く、かつ疾患部(放射線照射部)を選択的に攻撃する治療法を提案できると考えています。